Un article de Cristallographie.
(Différences entre les versions)
m |
|
| (6 révisions intermédiaires masquées) |
| Ligne 1 : |
Ligne 1 : |
| - | {| border="2" cellpadding="5" cellspacing="0" align="center" width="100% | + | {{Tableauproduit |
| - | |----- | + | |titre de l'image=Photo d'un cristal d'alun de potassium fabriqué au laboratoire |
| - | !colspan="2" bgcolor="#CCDDFF" align="center"| Photo d'un cristal d'alum de potassium fabriqué au laboratoire
| + | |image=xxx |
| - | |----- | + | |nom français=Alun de Potassium |
| - | |colspan="2" align="center"| xxx
| + | |nom anglais=Aluminium potassium sulfate |
| - | |----- | + | |autres noms=Alunite(mineral)<br/> |
| - | ! colspan="2" bgcolor="#CCDDFF" align="center"|Général
| + | |
| - | |-----
| + | |
| - | !Nom
| + | |
| - | | Alum de Potassium
| + | |
| - | |----- | + | |
| - | !Nom en anglais
| + | |
| - | | Aluminium potassium sulfate
| + | |
| - | |----- | + | |
| - | !Autres noms
| + | |
| - | |Alunite(mineral)<br/> xxx
| + | |
| | Sulfate double d'aluminium et de potassium dodécahydraté<br/> | | Sulfate double d'aluminium et de potassium dodécahydraté<br/> |
| | Potash alum | | Potash alum |
| - | |----- | + | |formule chimique type CuSO<sub>4</sub>=K<sub>3</sub>[KAl(SO<sub>4</sub>)<sub>2</sub>] (anhydrate)<br> |
| - | !Formule chimique
| + | [KAl(SO<sub>4</sub>)<sub>2</sub>·12H<sub>2</sub>O] (dodecahydrate) |
| - | |KAl(SO<sub>4</sub>)<sub>2</sub> (anhydrate)<br>
| + | |représentation spatiale= |
| - | KAl(SO<sub>4</sub>)<sub>2</sub>·12H<sub>2</sub>O (dodecahydrate) | + | [[Image:Représentation1_alun.gif]] <br> |
| - | | + | |
| - | XAl(SO<sub>4</sub>)<sub>2</sub>·ZH<sub>2</sub>O (Alun)
| + | |
| - | |----- | + | |
| - | !Représentation spatiale
| + | |
| - | |[[Image:Représentation1_alun.gif]] <br>
| + | |
| | [[Image:Représentation2_alun.jpg]] | | [[Image:Représentation2_alun.jpg]] |
| - | |----- | + | |couleur=Transparent |
| - | !Couleur
| + | |masse molaire=Anhydrate: 258.207 g/mol<br> |
| - | | Transparent
| + | |
| - | |----- | + | |
| - | !Masse molaire
| + | |
| - | | Anhydrate: 258.207 g/mol<br>
| + | |
| | Dodecahydrate: 474.39 g/mol | | Dodecahydrate: 474.39 g/mol |
| - | |----- | + | |fiche toxicologique=Peu dangereux, utilisé notamment comme cicatrisant et déodorant (pierre d'alun). |
| - | !Fiche toxicologique
| + | [http://www.cdc.gov/niosh/ipcsnfrn/nfrn1191.html Voir] |
| - | |Peu dangereux, utilisé notamment comme cicatrisant (pierre d'alun) et pour la pâte à sel pour enfant.
| + | |etat à 25°C=Solide |
| - | |-----
| + | |densité g/cm<sup>3</sup>=1,76g/cm<sup>3</sup> |
| - | ! colspan="2" bgcolor="#CCDDFF" align="center"| Propriétés
| + | |solubilité=114 g/l (20 °C) - 3330 g/l (100°C) |
| - | |-----
| + | |conservation= |
| - | !État de la matière à 25°C
| + | |Système cristallin=Cubique - Diploidal |
| - | | Solide
| + | |paramètre a= |
| - | |----- | + | |paramètre b= |
| - | !Densité
| + | |paramètre c= |
| - | | 1.76 g/cm<sup>3</sup>
| + | |Z= |
| - | |----- | + | |alpha= |
| - | !Dureté
| + | |beta= |
| - | | 2 (gypse)
| + | |gamma= |
| - | |-----
| + | |structure3D=[http://webmineral.com/java/Potassium-alum.shtml Voir le cristal d'Alum de potassium en 3D] <br> |
| - | !Solubilité dans l'eau
| + | [http://www.mindat.org/min-3267.html Voir aussi]<br> |
| - | | 114 g/l (20 °C) - 3330 g/l (100°C)
| + | |
| - | |----- | + | |
| - | !Conservation
| + | |
| - | | xxxxxxxxxxxx | + | |
| - | |----- | + | |
| - | ! colspan="2" bgcolor="#CCDDFF" align="center"| Structure cristalline
| + | |
| - | |----- | + | |
| - | !Système cristallin
| + | |
| - | |Cubique - Diploidal | + | |
| - | |----- | + | |
| - | !Dimmensions de la maille
| + | |
| - | |xxxxxx | + | |
| - | |----- | + | |
| - | !Structure en 3D<br/>
| + | |
| | Source: [http://webmineral.com/ webmineral.com] | | Source: [http://webmineral.com/ webmineral.com] |
| - | ||[http://webmineral.com/java/Potassium-alum.shtml Voir le cristal d'Alum de potassium en 3D] <br> | + | |image au microscope optique= |
| - | [http://www.mindat.org/min-3267.html Voir aussi]
| + | }} |
| - | |-----
| + | |
| - | ! colspan="2" bgcolor="#CCDDFF" align="center"| Analyse au microscope optique
| + | |
| - | |-----
| + | |
| - | |colspan="2" | Image
| + | |
| - | |-----
| + | |
| - | ! colspan="2" bgcolor="#CCDDFF" align="center"| Analyse au MEB
| + | |
| - | |-----
| + | |
| - | |colspan="2" | Image
| + | |
| - | |-----
| + | |
| - | |}
| + | |
| | | | |
| | La structure est constituée d’un assemblage de groupements sulfate et de groupements Cu(H2O)4 avec la cinquième molécule d’eau dans les cavités. | | La structure est constituée d’un assemblage de groupements sulfate et de groupements Cu(H2O)4 avec la cinquième molécule d’eau dans les cavités. |
| Ligne 85 : |
Ligne 42 : |
| | | | |
| | La cinquième molécule d’eau fait des ponts hydrogène avec deux groupements sulfate et deux molécules d’eau. | | La cinquième molécule d’eau fait des ponts hydrogène avec deux groupements sulfate et deux molécules d’eau. |
| - | | |
| | | | |
| | {{Navigation}} | | {{Navigation}} |
| | | | |
| | [[Catégorie:Produits chimiques]] | | [[Catégorie:Produits chimiques]] |
Version actuelle
| Photo d'un cristal d'alun de potassium fabriqué au laboratoire
|
| xxx
|
| Général
|
| Nom
| Alun de Potassium
|
| Nom en anglais
| Aluminium potassium sulfate
|
| Autres noms
| Alunite(mineral)
Sulfate double d'aluminium et de potassium dodécahydraté
Potash alum
|
| Formule chimique
| K3[KAl(SO4)2] (anhydrate)
[KAl(SO4)2·12H2O] (dodecahydrate)
|
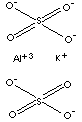
| Représentation spatiale
| 

|
| Couleur
| Transparent
|
| Masse molaire
| Anhydrate: 258.207 g/mol
Dodecahydrate: 474.39 g/mol
|
| Fiche toxicologique
| Peu dangereux, utilisé notamment comme cicatrisant et déodorant (pierre d'alun).
Voir
|
| Propriétés
|
| État de la matière à 25°C
| Solide
|
| Densité
| 1,76g/cm3
|
| Solubilité
| 114 g/l (20 °C) - 3330 g/l (100°C)
|
| Conservation
|
|
| Structure cristalline
|
| Système cristallin
| Cubique - Diploidal
|
| Dimensions de la maille
| a = , b = , c = , Z = ;
alpha = °, beta = °, gamma = °
|
Structure en 3D
| Voir le cristal d'Alum de potassium en 3D
Voir aussi
Source: webmineral.com
|
| Analyse au microscope optique
|
|
|
La structure est constituée d’un assemblage de groupements sulfate et de groupements Cu(H2O)4 avec la cinquième molécule d’eau dans les cavités.
Les atomes de cuivre occupent les sommets de la maille unité et le milieu de deux faces latérales. Ils sont chacun entourés de six atomes d’oxygène. Cet environnement est dit octaédrique parce que les six atomes d’oxygène forment un octaèdre dont le centre est occupé par l’atome de cuivre. Les six atomes d’oxygène autour de chaque atome de cuivre proviennent de quatre molécules d’eau et de deux groupements sulfate. Les distances oxygène-cuivre varient entre 1,94 et 1,99 Å pour les atomes d’oxygène des molécules d’eau et entre 2,38 et 2,43 Å pour les atomes d’oxygène des groupements sulfate.
Deux atomes d’oxygène de chaque groupement sulfate sont liés à un atome de cuivre, les deux autres forment des ponts hydrogène avec les molécules d’eau.
La cinquième molécule d’eau fait des ponts hydrogène avec deux groupements sulfate et deux molécules d’eau.


